
近日,应国际著名学术期刊Science邀请,江苏大学材料科学与工程学院潘国庆教授、苏州大学医学院李斌教授合作撰写的前瞻性文章”A dynamic biointerface controls mussel adhesion “ 在 Science 上发表。
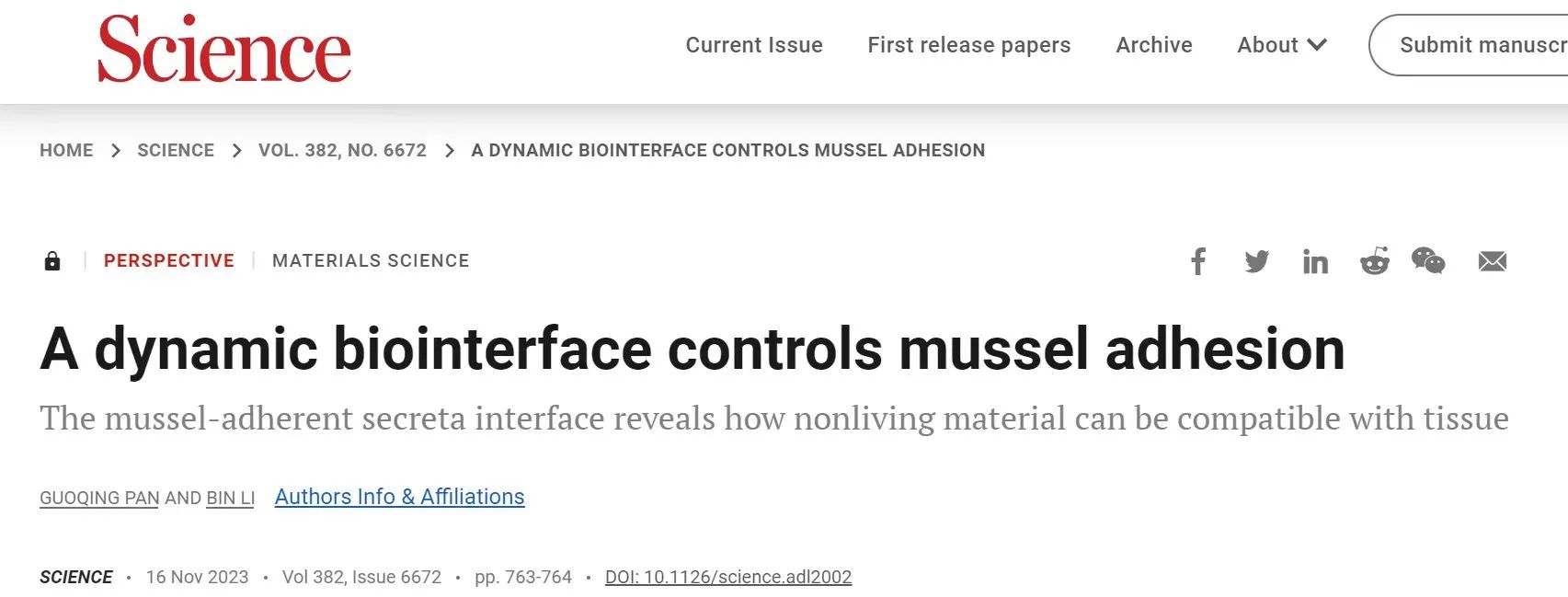
论文通过剖析加拿大麦吉尔大学(Doi: 10.1126/science.adi7401)和美国纽约大学(10.1126/science.abh1614)等研究人员近期发表的关于动态生物界面的重最新研究发现(具体见下面:麦吉尔大学和纽约大学等研究人员近期发表的关于动态生物界面的最新研究),并结合近年来医用材料表界面领域的最新进展,对生物材料仿生设计以及医用材料-组织的兼容性等相关问题进行了重点评述与展望。作者首先探讨了海洋贻贝的动态粘附机制,通过分析已被揭示的足丝(贻贝所分泌的非生命蛋白类材料)与自体组织之间的多尺度递阶结构(Multiscale hierarchical str ucture),强调多点微接触机制(Multipoint microcontacting mechanism)是贻贝-足丝动态生物界面间可控连接的关键,而非完全依赖其表面特殊的化学相互作用。指出,这种天然的动态多尺度递阶生物界面所涉及的多点微接触机制并非是贻贝类生物体内独有的,而且相关机制有望为动态的组织兼容性生物材料提供设计思路。文中特别提到,在爬行纲蜥蜴目壁虎类动物的尾部两段界面处也存在多尺度递阶结构,这一结构可确保尾巴与蜥蜴身体的稳定连接。然而当其受到威胁时,尾部摆动触发的局部微接触点破坏可引发整个界面的断裂,即自切行为(如下图)。
基于这些发现,作者提出独特见解,推断多点微尺度接触机制可能是实现强大而动态表界面相互作用的通用策略,而且这一机制可能同样存在于尚未探究的虾蟹类螯(爪)自断行为之中。文章最后,作者前瞻性地指出贻贝等生物所涉及的动态生物表界面有望为当前生物材料的组织细胞兼容性改善提供可行方案,并展望了相关结构的仿生构建在可拆卸植入材料(如生物传感器和医疗植入物),甚至在动态脑机接口等跨学科交叉领域的广阔应用前景。
原文链接
https://www.science.org/doi/full/10.1126/science.adl2002
麦吉尔大学和纽约大学等研究人员近期发表的关于动态生物界面的最新研究:2023年11月16日,加拿大麦吉尔大学Matthew J. Harrington教授团队使用先进的成像和光谱学方法来研究脱离过程。发现,这种快速释放的反应能力取决于纤毛的摆动运动,以及随后纤毛茎和贻贝足组织之间机械相互作用的变化。这种跳动运动可以受到血清素和多巴胺的影响,从而说明神经递质在控制生物和非生物组织之间的机械相互作用中的作用。研究人员揭示了贻贝组织和足丝之间的动态生物界面在贻贝中发挥着重要作用。这个发现可能为非生命材料如何与活组织动态连接提供信息,例如可拆卸生物传感器和医疗植入物。相关研究成果以题为“A strong quick-release biointerface in mussels mediated by serotonergic cilia-based adhesion ” 发表在 Science上。

足丝是贻贝分泌的无生命的蛋白质生物聚合物。足丝茎的近端转变为多个扁平且锥形的根,用于与活贻贝组织连接。足丝的可分离性质表明,活体组织和足丝茎根之间的强界面相互作用主要涉及非共价相互作用,这是一类可逆的分子间结合。然而,非共价结合通常很弱,那么它们如何支持非生命生物聚合物与贻贝中的活组织之间的牢固连接呢?先前的研究表明,可以使用互补的化学基团或不同的几何结构在表面上构建增强的非共价界面结合。例如,化学设计的氢键超分子系统可实现强底物相互作用。类似地,具有互补非共价结合的大环主客体化学用于增强界面粘附。然而,这些复杂的非共价表面在生命系统中很少发现,可能是由于它们潜在的毒性。相反,蛋白质足丝和活组织之间的天然生物材料界面不涉及特殊的化学物质。因此,其独特的结构可能为揭示生物界面的机械稳定性提供线索。
对于贻贝,每个旁丝通过粘合斑块粘合在其远端到硬表面,并且像树干上的树枝一样附着在其近端到茎(图1C)。在其基部,圆柱形外部茎过渡到更加扁平和锥形的内部茎根(14)。干根将整个旁脉锚定到脚底部的活组织中,该区域称为发生器,也是负责形成干的分泌组织(图1,A 至 C)。考虑到速度可以超过30米/秒的冲击波所产生的力,这就需要一个强大的界面。然而,贻贝能够莫名其妙地抛弃它们的全部,然后在几个小时内制造一个新的。虽然诱导这种行为的线索仍然是未知的,通过释放使无蒂贻贝能够重新获得移动性和爬行跨越基质,甚至比例垂直表面。这样的运动可能使贻贝迁移和逃离不利的条件(例如,升高的温度,捕食者,海浪暴露,不合适的基质)。因此,虽然茎生物聚合物和发生器组织之间的界面必须非常强大以抵抗波浪力,但其强度也必须能够动态调节以便能够快速释放。最近对一种远亲贻贝的研究揭示了在茎根-组织界面的化学相互作用是由金属配位和糖结合介导的。然而,关于贻贝科贝壳释放机制及其与茎根超微结构的关系研究很少。

图1. 贻贝足丝茎根微尺度层次结构
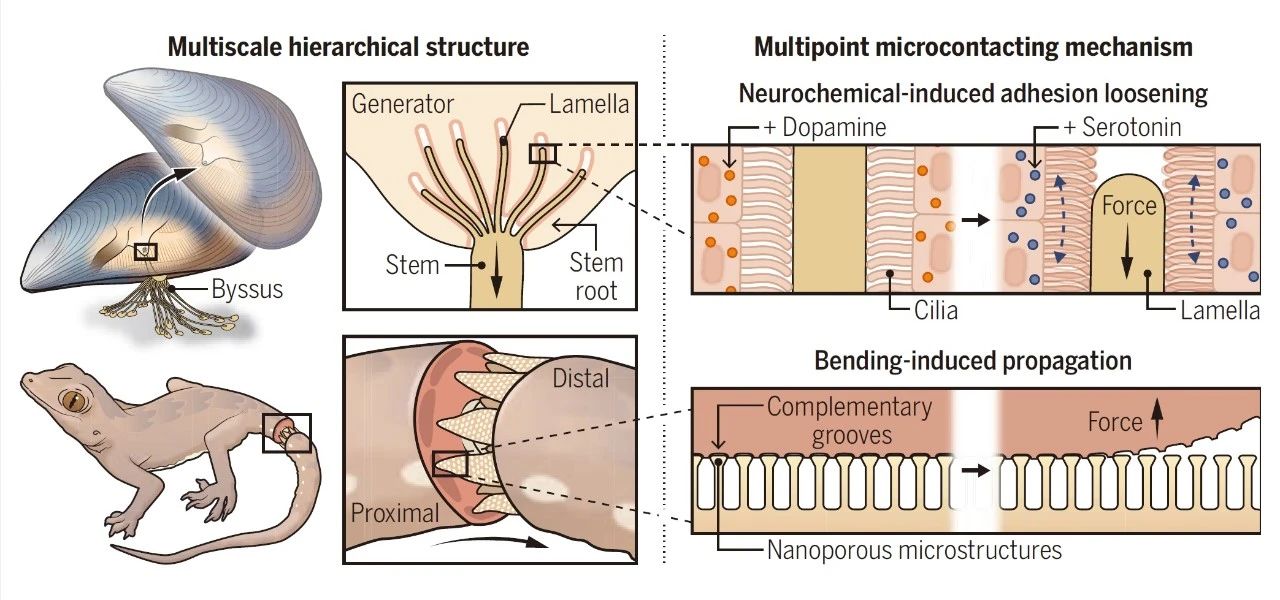
为了以更高的分辨率观察生成间隔和茎根片之间的界面,使用聚焦离子束扫描电子显微镜(FIB-SEM),这可以实现约20纳米分辨率的小组织体积的三维重建。图2A显示了FIB-SEM图像堆栈中的单个图像,以假颜色突出关键特征(即隔膜、纤毛、片状体和分泌囊泡),然后使用FIB-SEM图像堆栈以3D重建。这突出了纤毛与片状体之间直接和亲密的相互作用,当纤毛与片状体表面接触时,凹痕明显。以前确定的含有用于构建茎的分泌囊泡在隔膜-层界面排列(图2C),随着纤毛的扩散,可能会使囊泡保密。有人提出,随着每产生一条新的旁线,茎会从脚向外延伸,这表明茎生长的一种挤压状机制。囊泡的形状类似于特征良好的分泌囊泡,这些囊泡含有形成旁丝的液晶胶原质前体。
发电机组织的罐头透射电子显微镜(STEM)成像提供薄片和纤毛-薄板界面内部结构的其他细节(图2,D到G)。虽然薄片与FIB-SEM均匀,但STEM的更高分辨率揭示了具有纤维状核心和与纤毛直接接触的更mor-phous外部区域的异质结构。根据微管的特征组织成所谓的9+2轴膜,可以假设纤毛是可移动的,其中九个微管双倍围绕着纤毛中心的两个单微管。STEM图像表明,纤毛被紧紧压入薄片的外层,与FIB-SEM成像一致,表明薄片表面相对柔软(图2E),而可以看到分泌囊泡被压在准备分泌的纤毛之间(图2F)。周围的隔膜ECM表现出以多姆为导向的薄纤维,具有特征条带,根据组织学染色,假设这些带是胶原蛋白的(图2G)。
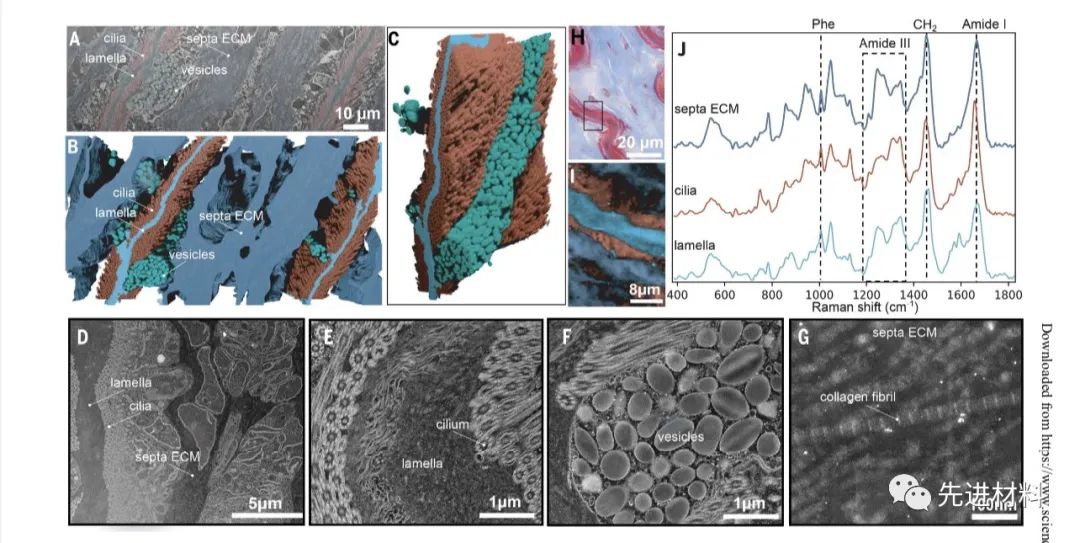
图2. 茎生成器生物界面的结构和成分分析
鉴于干根片层与隔膜 ECM 纤毛之间的密切相互作用,研究了干根释放的组织水平效应(图3)。如前所述,通过对胚珠施加持续的亚临界力来诱导胚珠释放,没有显示出茎根损伤的迹象。诱导茎释放后立即进行的发生器组织的组织学分析显示纤毛之间的空隙(图3D) ,其中在天然样品中观察到层片(图1G 和3C)。图像显示红色染色的纤毛没有损伤,也没有蓝色染色的片状物质的痕迹,支持一个干净的释放。诱导茎根释放后发生器组织的拉曼成像进一步支持干净、快速释放,没有相关组织损伤(图3,F 至 H)。相反,在强制切除干根显示明显损伤的地方,我们观察到发生器组织切片中残留的断裂板层(图3E)。
通过天狼星红染色(图3I)进一步分析干净释放的茎根片层,显示完整的未受损片层,没有纤毛或细胞碎片残留。与 STEM 成像一致,释放的片层显示嵌入在非染色材料中的红色染色的弯曲纤维,证实片层确实是双相的,具有纤维胶原核心组分和直接与纤毛相互作用的非胶原组分。释放的层状材料的拉曼光谱成像进一步支持具有强烈类似于近端线和外部非胶原组分的胶原核心光谱的双相组合物,显示更无序的二级结构(图3,J 和 K)。
图3. 茎释放的组织学和光谱特征
基于茎片层的清除释放,我们提出了两个假设: (i)隔膜表面和茎片层之间的相互作用是强烈的,但可逆的和非共价的。(ii)茎的释放似乎受到生物学控制,并可能涉及纤毛,因为它们与叶片有紧密的相互作用。为了验证这些假设,我们利用了这样一个事实: 通过添加5-羟色胺和多巴胺,先前已经显示贻贝鳃和消化系统的运动纤毛在体外上调和下调。(图4A)为了测试纤毛跳动是否可能影响干释放,以剂量依赖性方式将5-羟色胺和多巴胺独立注射到干与干之间的开放间隙中,而不干扰组织,并且通过机械测试测量去除干的最大力。注射200mM 5-羟色胺后,由于将干细胞连接到拉伸测试仪的行为导致干细胞释放 ,因此不可能测量,所以可以很容易地以如此小的力量去除干细胞。5-羟色胺呈剂量依赖效应,较高的拔出力与较低的5-羟色胺浓度相关。
相比之下,多巴胺注射在70 mM多巴胺下将去除茎的力量显著增加到20.1 ± 5.9 N(相比之下,仅注入水的对照组为6.7 ± 1.7 N)。在这些高力下对发电机的组织学分析表明,隔膜之间破裂的薄片残留物(图3E)。多巴胺还显示出明显的剂量依赖性(图4A),但200 mM多巴胺的最大力大幅下降到3.2 ± 0.3 N。进一步检查显示,在这些样本中,失败不是因为茎被释放,而是因为整个发电机破裂并拉离了底层肌肉 - 尽管茎-发电机的生物界面仍然完好无损。这可能表明与部分纤毛运动相结合的重要强化作用。
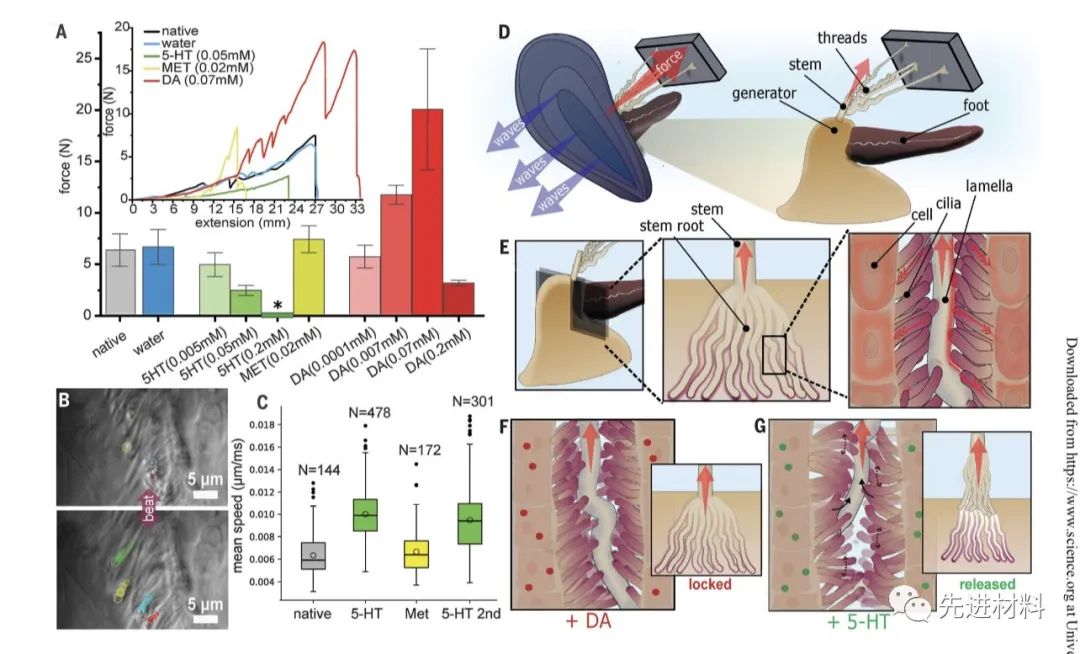
图4. 纤毛和神经递质在茎释放中的作用
因此,关键问题不在于为什么茎根生物界面如此强大,而在于如何能够按需释放而不会失败。为了脱离表面,壁虎通过向后滚动脚趾来改变施加力的角度,这使得压力集中在较少的单个键上,从而促使快速释放。也许类似于壁虎脚趾滚动 ,已经观察到在干根生物界面处的运动纤毛可以在适当的神经化学触发下相对于板层表面积极移动(图4,F 和 G)。这种振动明显破坏了纤毛和片层表面之间的粘附相互作用,使得整个茎根在亚临界力作用下得以释放(图4G)。推测,纤毛移动的数量和/或它们跳动的速度可以调节移除旁腺所需的总体力,使观察到的5-羟色胺和多巴胺剂量依赖性的拔出力,并允许贻贝抛弃它们的旁腺而不损伤组织内(图1)。
与这一假设一致,已经表明,Mytilus edulis足部和鳃组织上皮衬里上的纤毛受多巴胺能神经和血清能神经调节,血清素具有兴奋作用,多巴胺对睫状节拍具有抑制作用。因此,可以合理地假设发电机中的血清能和多巴胺能神经纤维包含一个复杂的反馈系统,用于调节生物界面强度和释放。作为支持,诱导的拉出体验可能表明存在机械感官途径,之前已经表明,热应激治疗会增加M.edulis中枢神经系统的血清素水平,鳃纤毛跳动率随着温度的升高而增加。这符合高温潮汐池中的贻贝将释放它们的麝香进行搬迁的建议。
因此,假设,mus-sels可能会将有关其环境的感官信息转化为神经化学信号,转化为增加的纤毛跳动,从而实现旁观释放和增加流动性,这可能会增强贻贝在不利条件下的生存。再加上纤毛跳动增加,旁收缩肌施加的力量可能足以诱导自发释放。如果没有旁白附着物,贻贝可以自由地用脚拉动自己,在放下新的旁人之前找到合适的位置。这意味着一个复杂的感官系统,可以将物理、化学和机械刺激转化为发电机中的特殊神经化学信号。虽然介导这种机制的细胞机制仍在阐明中,但在这里证明,Mytilid byssus茎根为活组织与人类技术中找不到的非生物材料接口提供了一个有效的快速释放机制的例子。
原文链接
https://www.science.org/doi/10.1126/science.adi7401
2023年11月17日,纽约大学Yong-Ak Song 教授团队提出了一种基于多尺度分层结构的蜥蜴尾部自切断术仿生断裂模型。该结构由均匀分布的纳米孔顶微柱组成,与蜥蜴尾部肌肉断裂平面上的高密度蘑菇状显微结构相重合。仿生实验表明,结合纳米多孔界面表面与柔性微柱在拉伸和剥离模式时的附着力增强。断裂模型确定了基于微观和纳米结构的增韧机制是关键因素。在潮湿的条件下,毛细现象辅助能量耗散有关液体填充的微间隙和纳米孔进一步增加的粘附性能。本研究提出了蜥蜴尾巴自切的见解,并提供了新的仿生思路来解决粘连问题。相关研究成果以题为“Biomimetic fracture model of lizard tail autotomy ” 发表在 Science上。

当受到攻击时,蜥蜴会甩掉尾巴来逃避捕食者,同时留下一个摆动的诱饵来分散敌人的注意力。尾巴需要牢牢地连接在一起,但它也必须有一个快速释放机制,在正常活动中不会参与。本文作者为尾部依附设计了一个多尺度的层次模型。尾部破碎表面的显微数据表明,断口由蘑菇状柱组成,顶部有纳米孔。这些支柱允许增强尾部在拉伸和剥离模式下的附着力,但在振荡弯曲过程中使其断裂。作者使用聚合物模型和建模证实了他们的假设。
原文链接
http://www.doi.org/10.1126/science.abh1614
以上文章转载于化学与材料科学,如有侵权,请及时联系我们修改或进行删除。