
自然生物体中的体感、神经肌肉和组织系统对于实现各种功能至关重要,从感知环境刺激、促进复杂的肌肉收缩到愈合伤口。凭借这些优点,人类灵巧的手和其他具有部分完全柔软结构的生物,如章鱼触手和象鼻,能够自主恢复损伤和完成各种自我感知的连续任务。从大自然中汲取灵感,已经培育出了这种更接近先进软机器人的人工材料智能软体感致动器,它同时表现出刺激响应运动和自我感知功能。例如,通过与电阻元件耦合,在概念上展示了由液晶弹性体包围的热响应液态金属机器人,该机器人具有规定的可收缩致动器和自感能力,实现了可编程的形状转换行为和闭环自调节感知。还制造了具有电容式压力传感器的仿生气动致动器,分别允许多模式传感能力和多种类型的复杂变形。然而,大多数现有的软体感致动器缺乏自修复能力,并且经受复杂的集成操作,包括多步骤成型、伴随复杂连接端子的层压以及物理集成系统接口处的分层组件的粘附。

通过刺激响应聚合物和均匀导电网络以简单的程序实现,几种已报道的软体感致动器在一定程度上实现了分子水平的融合。例如,MXene/聚(3,4-亚乙基二氧噻吩)或聚苯胺被均匀地结合到聚(N-异丙基丙烯酰胺)水凝胶中,其同时将光致动和感知(压阻或应变传感)集成到具有二合一功能的单一材料中。然而,这些系统仍然缺乏自修复能力,并且由于均匀嵌入网络中的导电材料含量相对较高,在应变敏感性和形状可编程性方面具有固有的局限性。此外,不足的致动性能和机械性能,以及通过令人烦恼的吸水/排水操作来实现形状变形,也极大地阻碍了软体感致动器的发展。因此,在分子水平上,通过简单可行的操作,采用一种具有快速致动、准确的自我感知、良好的自修复和高机械性能的新结构将是非常可取的。
我们的策略灵感来自柔软的章鱼触手,它可以通过与神经肌肉系统和分布良好的效应器协调来实现局部运动,允许神经索和受体传递神经信号进行有效反馈,并在受伤时通过生物组织系统治愈生物体。在这种自然的设计理念的熏陶下,我们有足够的动力来模仿结构。在类似于效应器和神经肌肉系统的聚二甲基硅氧烷基(PDMS基)基质中采用快速可见光驱动(450 nm)苄基亚胺官能化的蒽,允许各种运动,因为改性的蒽诱导红移的最大吸收峰并增强光化学反应性。通过简单的基体预拉伸,在弹性恢复过程中施加可见光照射,形成沿厚度方向的交联梯度。而由膜两侧自主卷曲的聚合物链引起的逐渐恢复的轴向驱动力使膜产生宏观运动。此外,将少量碳纳米管(CNT)作为有效的光热剂混合到基质中,以吸收来自近红外光(NIR,808 nm)的能量,从而去除蒽的二聚化。因此,在一次预拉伸之后,可以实现由光致动的多个可逆和可控循环。为了发挥组织系统的作用来修复所遇到的损伤,在基于PDMS的矩阵中引入了多种动态相互作用,其中π–π堆叠主要为系统提供韧性和弹性;氢键和二硫键通过可逆的键断裂和重新定位来耗散应变能,并导致自修复能力。此外,高导电性银纳米线(AgNWs)被用来嵌入光驱动基质的表面,充当神经索和受体,并负责信号的传递,由于拉伸时纳米线之间的滑动和动态硫代银配位相互作用(Ag─S) 这可以稳定结构框架。同时,自修复系统的动态重构将有助于受损薄膜恢复其高导电性,并增加Ag─S配位相互作用将更有利于结构的恢复和稳定。
本文亮点
1. 本工作报道了一种受生物启发的导电光响应结构。分别利用快速光响应蒽、具有动态相互作用的自修复基质以及与基质化学集成的高导电性可滑动银纳米线来模拟章鱼触手的神经肌肉系统和效应器、生物组织系统以及神经索和受体。
2. 这种柔软的体感执行器表现出快速的驱动(光驱动弯曲速度,10o s−1)、独特的内在应变敏感性(应变系数,90.88)和良好的自愈效率(92.2%),举重和物体抓取,可以通过实时阻力变化同时检测动作并提供信息反馈。
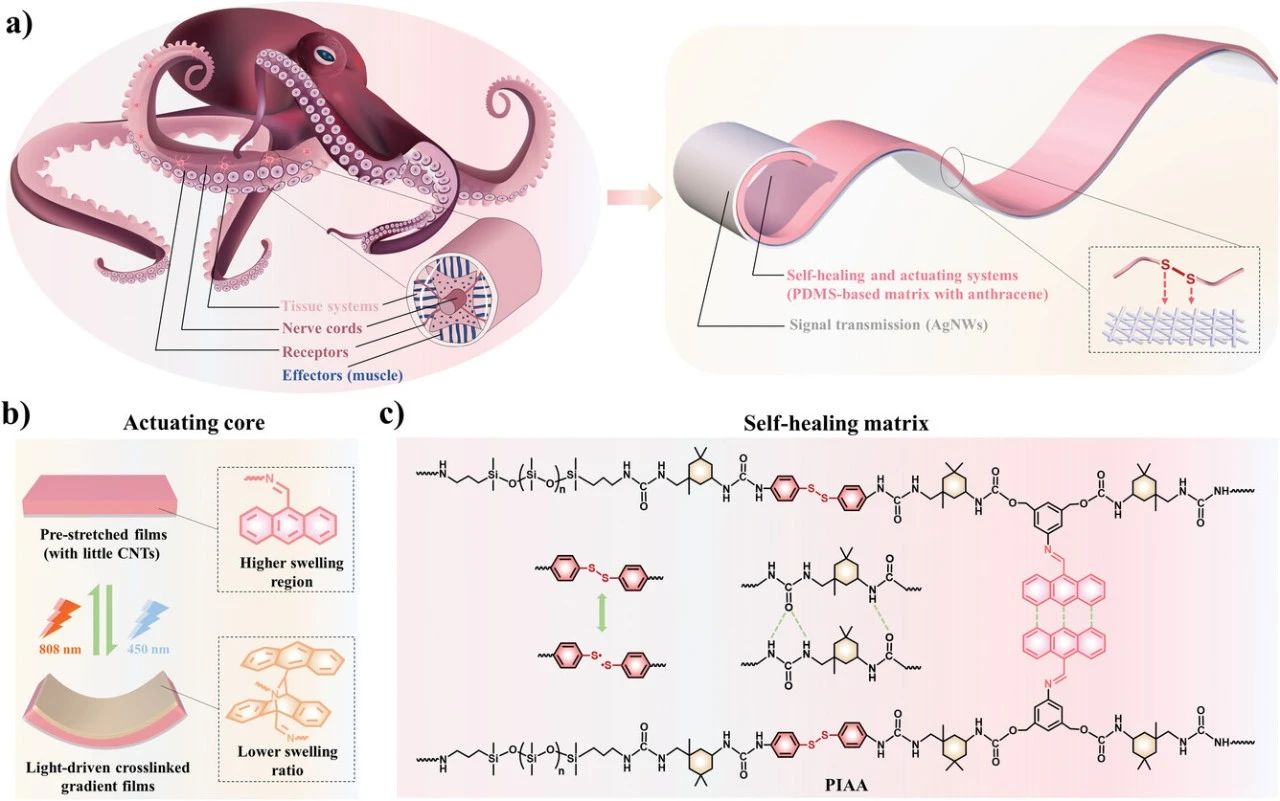
图1. 章鱼触手的概念设计启发了自愈软体感执行器。a) 章鱼触手的多功能实现,通过各种功能组件的合作,以及基于仿生自修复导电光响应PDMS的架构的示意图。Ag嵌入光驱动薄膜表面的高导电性可滑动银纳米线─S协调相互作用充当神经索和受体,用于实时信号的传输和即时信息的反馈。b) 在可见光和近红外光交替照射下,作为神经肌肉系统驱动核心和效应物的改性蒽的结构变化示意图。柔软的体感致动膜向光源弯曲。c) 基于PDMS的自修复基质作为生物组织系统的示意图,该系统由氢键、二硫键和π–π堆积等多种动态相互作用组成。
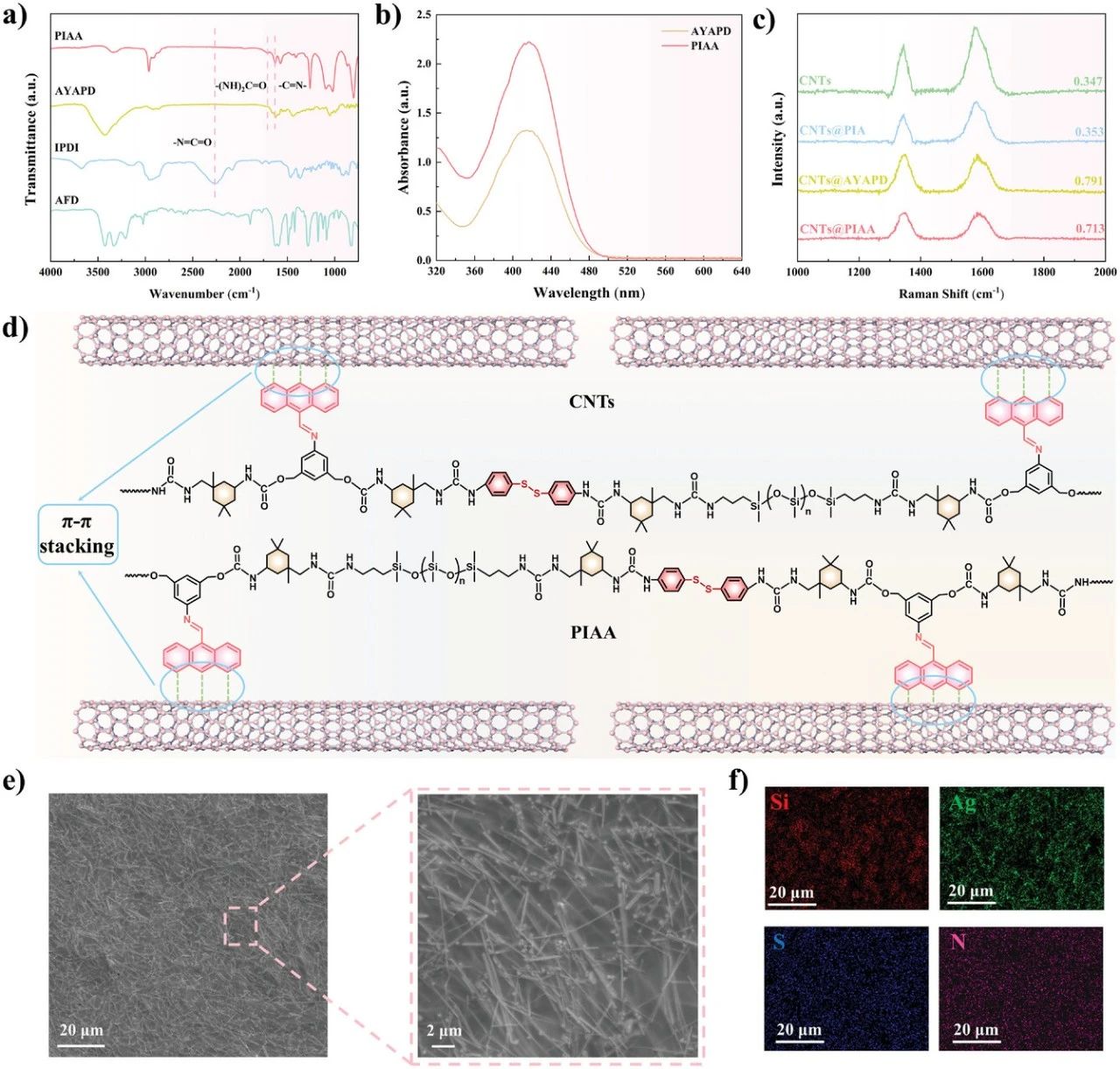
图2. 自修复导电光响应PDMS体系结构的合成与表征(CNTs@PIAA-AgNWs)。a) AFD、IPDI、AYAPD和PIAA的FT-IR光谱。b) PIAA和AYAPD在THF溶液(10−5 m)中的紫外-可见吸收光谱比较。c) CNT、PIAA和PIAA的拉曼光谱,CNTs@PIA和CNTs@PIAA-AgNWs.d)PIAA基质(蒽基)和CNTs之间π–π相互作用的示意图。e) 复合膜SEM图像的不同放大倍数。f) 中Si、Ag、S和N元素的元素映射CNTs@PIAA-AgNWs电影。
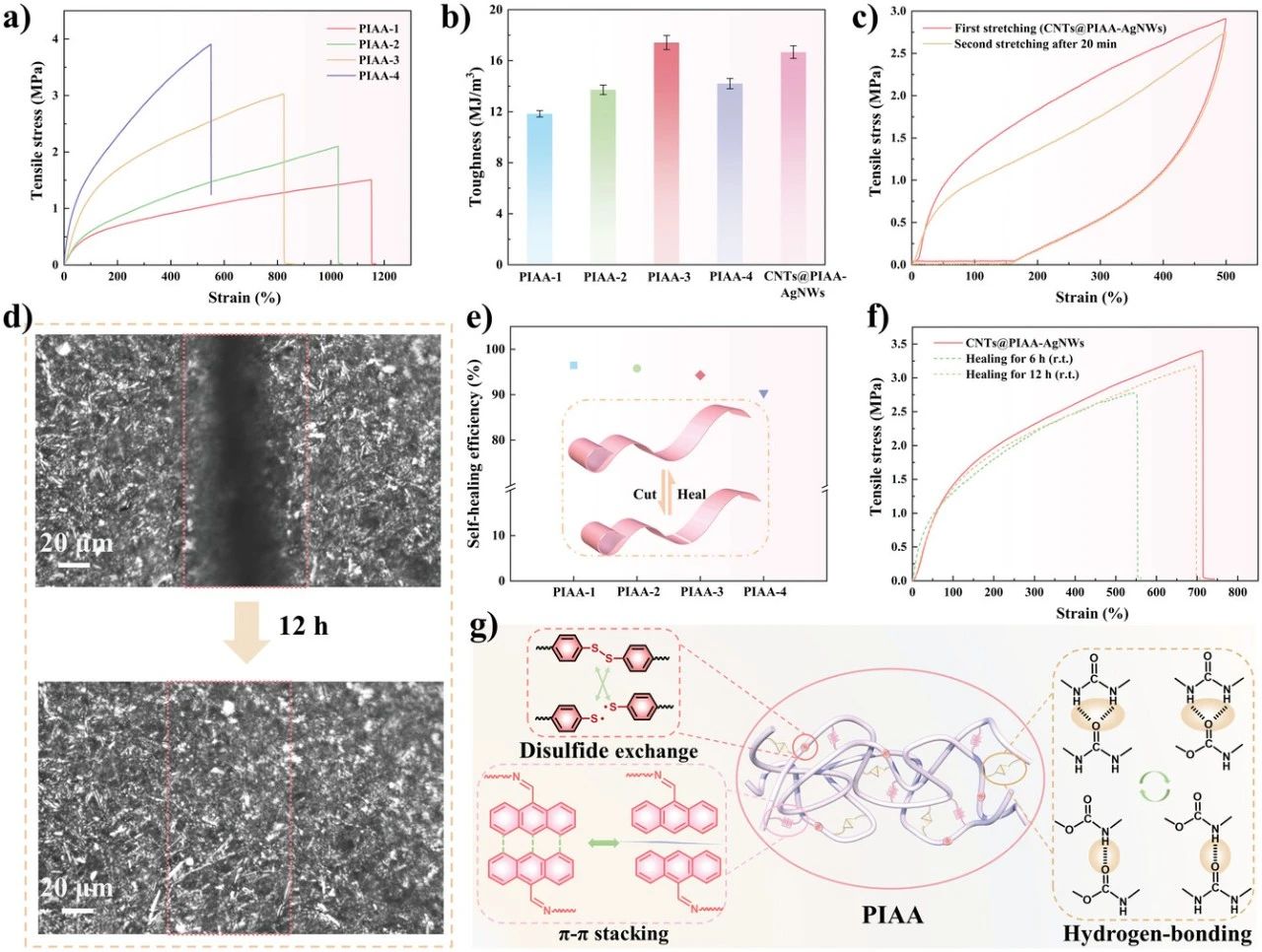
图3. 基于自修复导电光响应PDMS架构的机械和自修复性能。a) 一系列PIAA弹性体的应力-应变曲线(20 mm min−1)。b) PIAA弹性体和CNTs@PIAA-AgNWs电影。c) 循环应力-应变试验CNTs@PIAA-AgNWs电影第二次拉伸是在第一次拉伸后休息20分钟进行的。d) 自修复导电光响应膜的自修复过程(室温下12小时)的光学显微镜观察。e) PIAA弹性体的自愈效率。插入的图像显示了弹性体膜的自修复的示意图。f) 初始和自愈的应力-应变曲线CNTs@PIAA-AgNWs不同愈合时间下的电影。g) 仿生结构中包括氢键、二硫键和π–π堆积在内的多种动态相互作用的工作形式示意图。
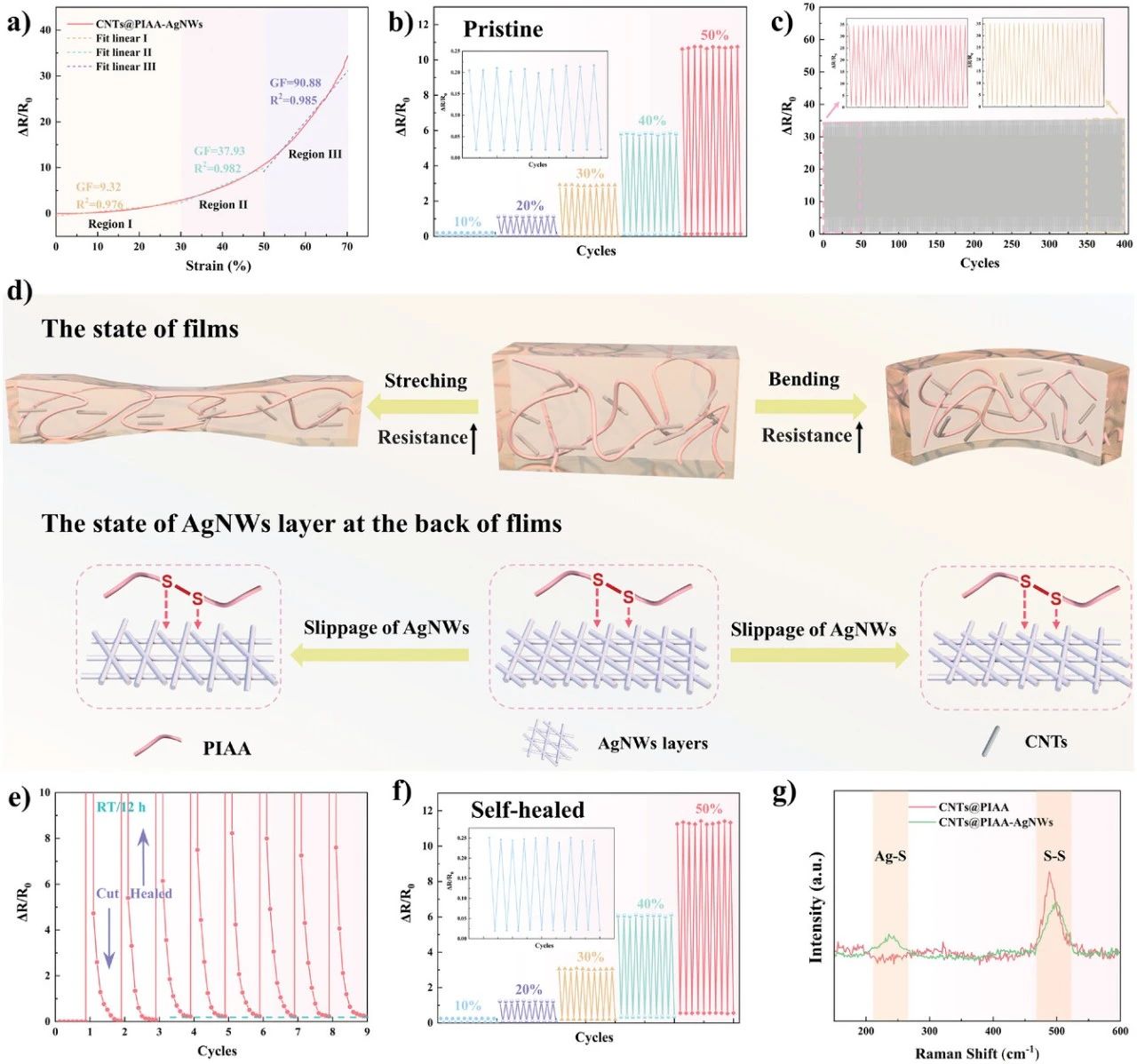
图4. 基于自修复导电PDMS架构的传感性能。a) 自修复复合膜的相对电阻随应变的变化。b) 导电膜在不同最大应变(10%、20%、30%、40%和50%)下的多循环灵敏度测试。c) 结构在循环拉伸(70%应变下400次循环)下的相对电阻变化。d) 电阻振动机构的示意图CNTs@PIAA-AgNWs具有可逆拉伸和弯曲的薄膜。e) 在多次循环切割过程(通过沿膜的整个宽度引入2N的机械强度划痕)和自修复之后,对导电膜进行灵敏度测试。f) 自修复导电膜在循环加载-卸载下的相对电阻变化(由于沿膜的整个宽度施加划痕而导致的2 N的机械强度的损伤)。g) 在CNTs@PIA和CNTs@PIAA-AgNWs.
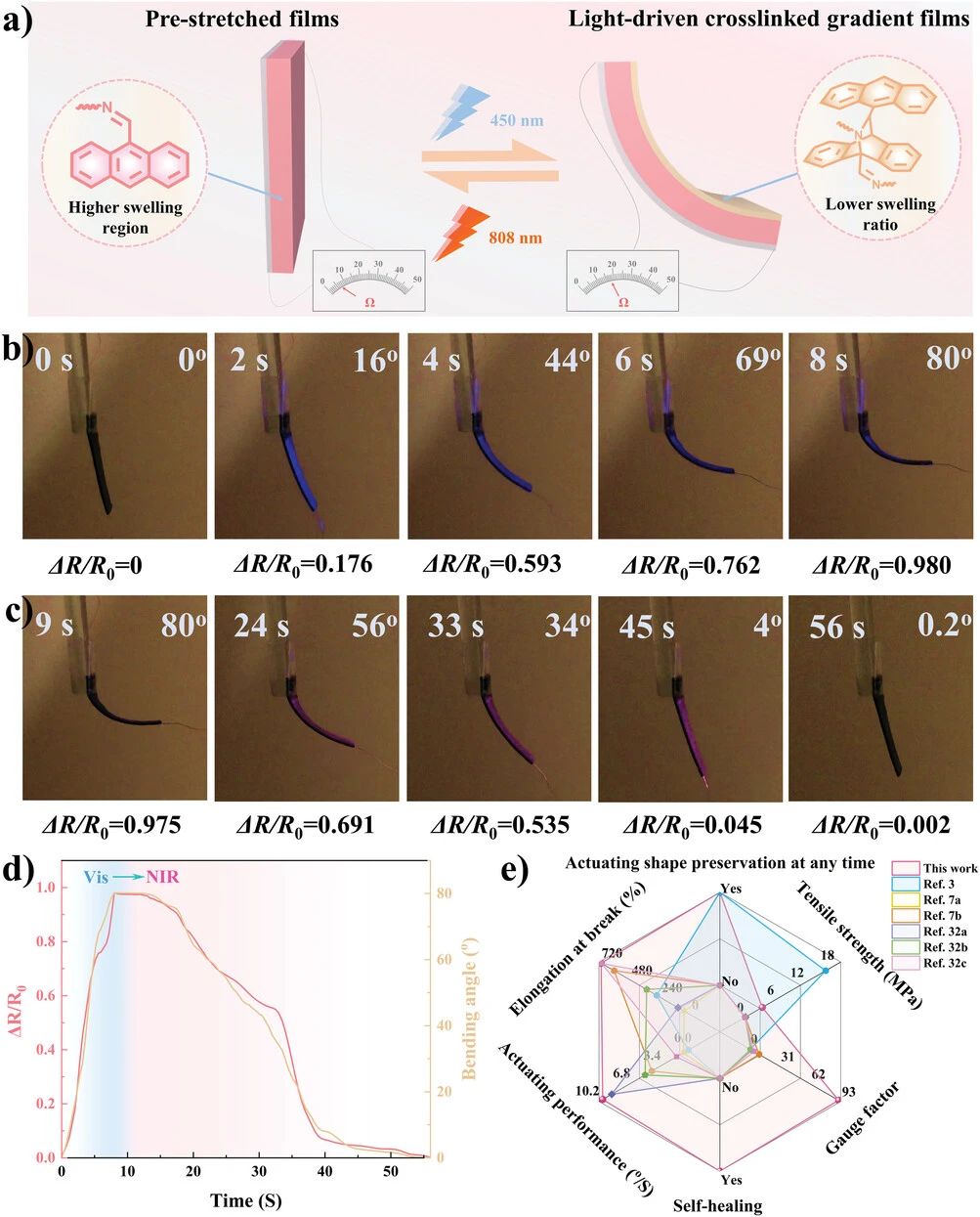
图5. 基于自修复导电PDMS架构的光驱动行为和感知特性。a) 自愈体感致动器的光致致动和实时电阻变化机制示意图。预拉伸致动膜的形状变形和相对电阻在暴露于b)可见光照射(450 nm,20 mW cm−1)和c)近红外光(808 nm,500 mW cm–2)时变化的照片。d) 在可见光和近红外光下,体感致动器的弯曲角度和相对电阻随照射时间的变化。e) 基于自修复导电PDMS的结构与先前报道的自感软致动器的综合性能比较。
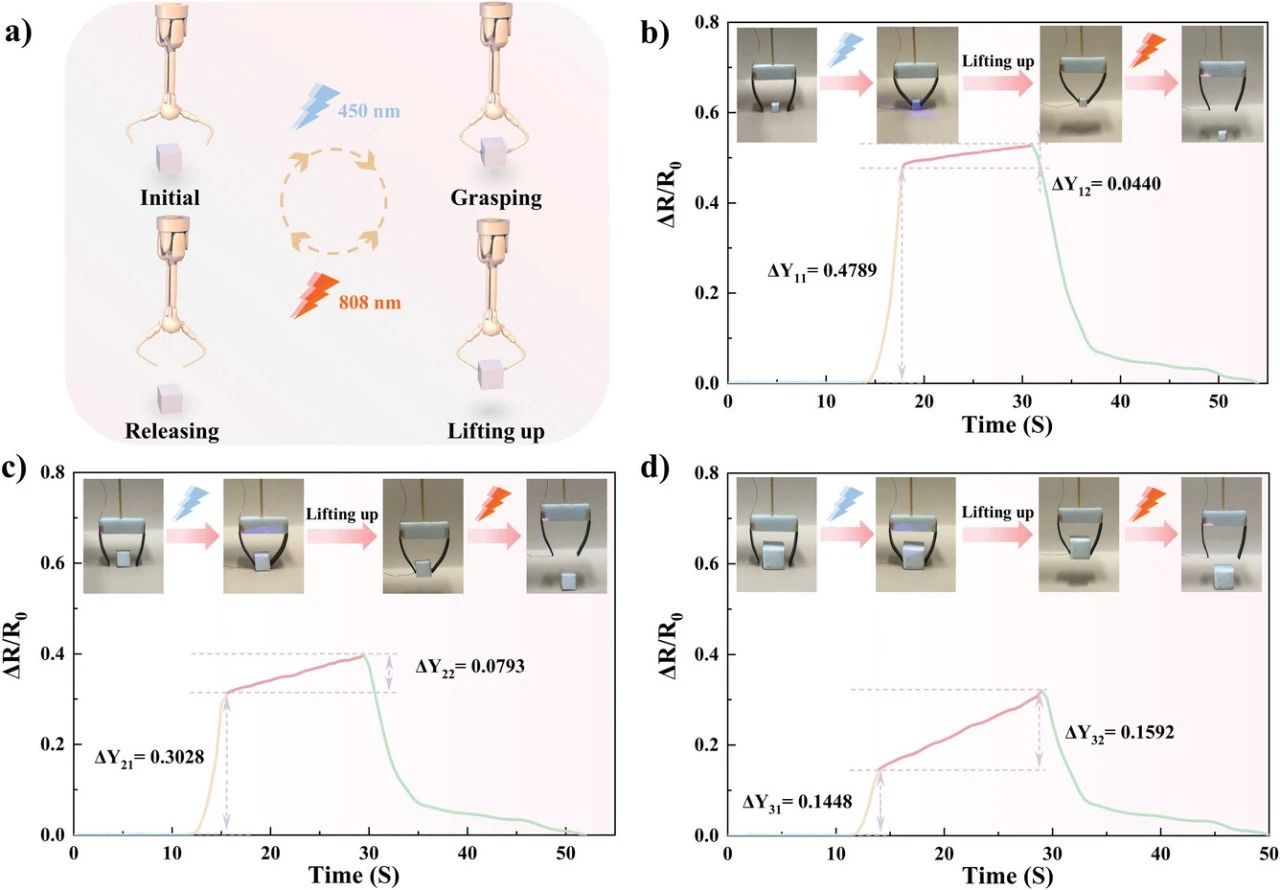
图6. 基于自修复导电PDMS架构的体感驱动。示意图a)和仿生智能手爪在抓取不同尺寸的海绵(b)0.5×0.5×0.5 cm、c)1×1×1 cm和d)1.5×1.5×1.5 cm)时的相对阻力变化曲线。
以上文章转载于微信公众号国际仿生工程学会,如有侵权,请及时联系我们修改或进行删除。