
尽管包括蛋白、核酸在内的生物药物具有广泛的医疗应用前景,但是如何向细胞内高效递送(高转染效率、高活性)这些生物药物仍然是一个棘手的问题。现有的药物递送载体进入细胞大多通过内吞作用,它们进入细胞后大部分被溶酶体降解和被胞吐到细胞外,只有不到10%的药物能够进入细胞质。肌动蛋白(Actin)是细胞骨架的重要组成部分,在细胞的迁移、分裂、原生质的流动、囊泡和细胞器的运动、细胞间信息的传递、细胞的形状等细胞活动中扮演着重要的角色。肌动蛋白分为球状肌动蛋白(G-actin)和丝状肌动蛋白(F-actin)。G-actin通过非共价作用聚集成F-actin的过程被发现能够增加细胞膜的张力,促进膜融合过程。因此,仿生F-actin可能是构建药物递送纳米平台的一种新策略。近期,西安电子科技大学王忠良团队开发了一种仿生F-actin的纳米平台用于蛋白质的高效细胞质递送。该纳米平台展现出与细胞膜模拟物的快速融合,能通过膜融合作用将蛋白质药物递送进入细胞质,产生极高的蛋白转染效率和转染活性(图1)。
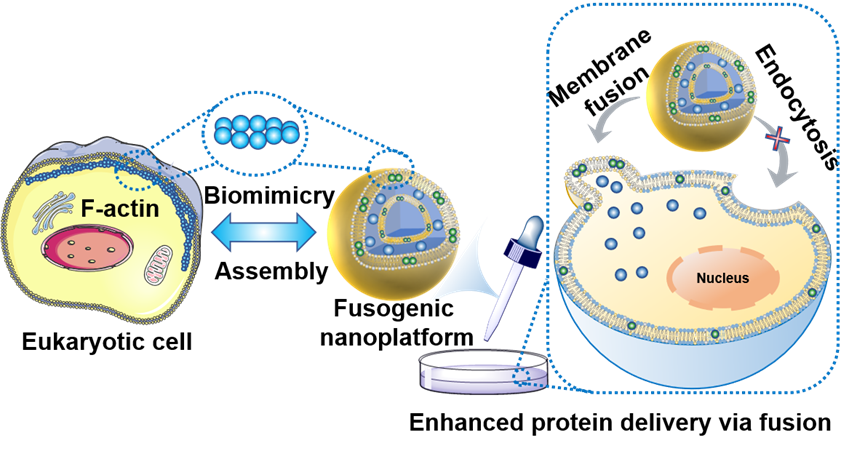
图1 仿生F-actin脂质体通过膜融合方式递送蛋白质的过程示意图
具体而言,作者首先设计嵌在脂质双分子层中的花菁染料CyBI7聚集体模拟支撑细胞膜的非共价键聚集体仿生丝状蛋白(F-actin)的,得到CyBI7-IL。如图2a,CyBI7-IL的近红外吸收峰相比游离CyBI7明显红移,证明CyBI7确实在脂质双分子层中形成了聚集体,而对照组DiR-IL中染料并未发生聚集(图2b)。进一步的分子动力学模拟证实CyBI7在IL的脂质双分子层中形成包含2-4个单体的小聚集体,并呈现出典型的J聚集形态(滑移的平面)。表面张力的计算结果则进一步证实了CyBI7聚集体具有增加膜张力的作用,CyBI7-IL与不含CyBI7的IL的表面张力分别为-4.7 mN/m和-0.32 mN/m (图2c). 脂质体中CyBI7聚集体产生的张力约等于4.7万个F-actin分子产生的张力,证明CyBI7聚集体有仿生F-actin的潜力。体外膜融合效率测试表明,CyBI7-IL确实具有很高的膜融合效率,10 min内已经达到90%以上(图2d)。作者进一步验证了CyBI7-IL对模型蛋白的递送能力。蛋白质活性是评估蛋白递送效果的重要指标。β-半乳糖苷酶(β-Gal)是一种能和底物反应生成蓝色物质的模型蛋白。其自身进入细胞非常困难,而用CyBI7-IL不仅可以高效递送β-Gal进入细胞质,而且其活性高达94%,而常用的商品化脂质体转染试剂lipofectamine 3000 (LPF3k)组的蛋白活性仅有34%,暗示了膜融合脂质体在递送生物大分子方面的优越性(图2e)。此外,细胞摄取机制研究表明CyBI7-IL进入细胞完全不依赖于内吞过程(图2f)。绿色荧光蛋白(GFP)也是蛋白递送研究中常用的模型蛋白。作者通过GFP进入细胞后与溶酶体的共定位较少,证明了CyBI7-IL通过膜融合方式递送蛋白进入细胞(图2g)。最后,作者用CyBI7-IL递送了抗肿瘤蛋白DNase I,发现其抗肿瘤效果明显优于对照组,暗示了CyBI7-IL具有较好的蛋白递送应用潜力。这项研究提供了一个高效的蛋白递送工具。该工具也可以拓展用于递送质粒和mRNA等核酸药物,为基因治疗和细胞治疗提供重要支持。
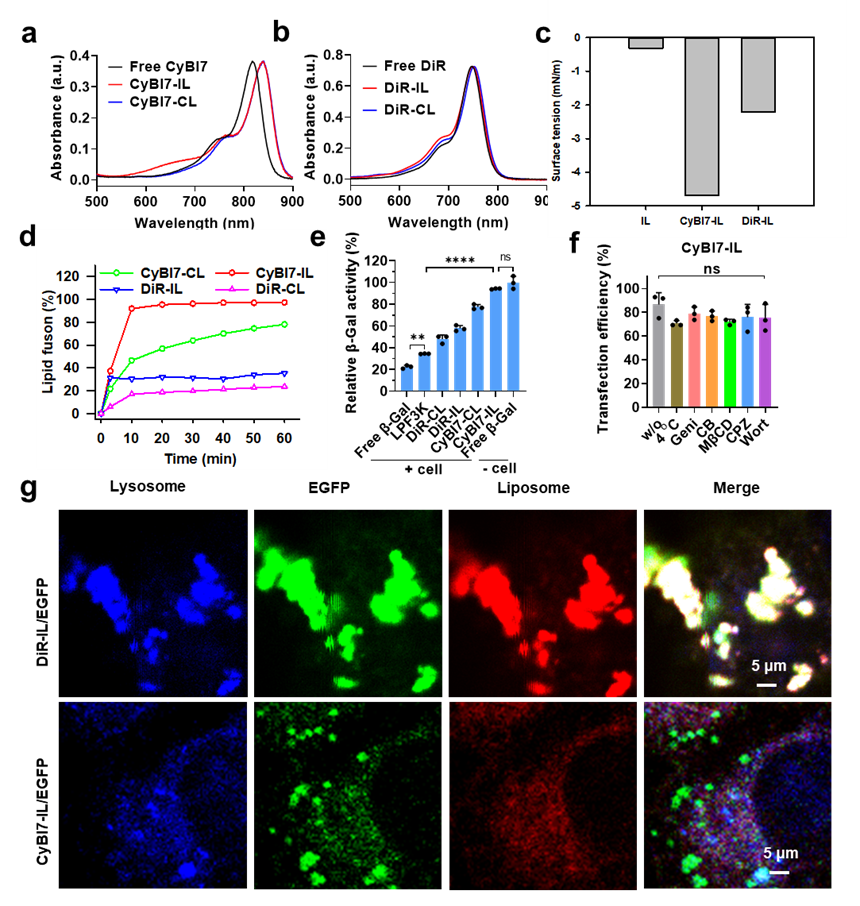
图2 (a)CyBI7-IL的近红外吸收光谱。(b)对照脂质体DiR-IL的近红外吸收光谱。(c)CyBI7-IL及对照脂质体的表面张力。(d)CyBI7-IL及对照脂质体的膜融合动力学过程。(e)CyBI7-IL递送β-半乳糖苷酶(β-Gal)的酶活性表征。(f)CyBI7-IL递送β-半乳糖苷酶(β-Gal)的细胞摄取机制。(g)CyBI7-IL和DiR-IL递送EGFP的溶酶体共定位结果。
相关工作以“Filamentous-Actin-Mimicking Nanoplatform for Enhanced Cytosolic Protein Delivery”为题发表在Advanced Science (DOI: 10.1002/advs.202305600)上,文章第一作者为西安电子科技大学夏玉琼副教授,通讯作者为西安电子科技大学王忠良教授,共同通讯作者为西安电子科技大学张象涵副教授。
以上文章转载于微信公众号AdvancedScienceNews,如有侵权,请及时联系我们修改或进行删除。